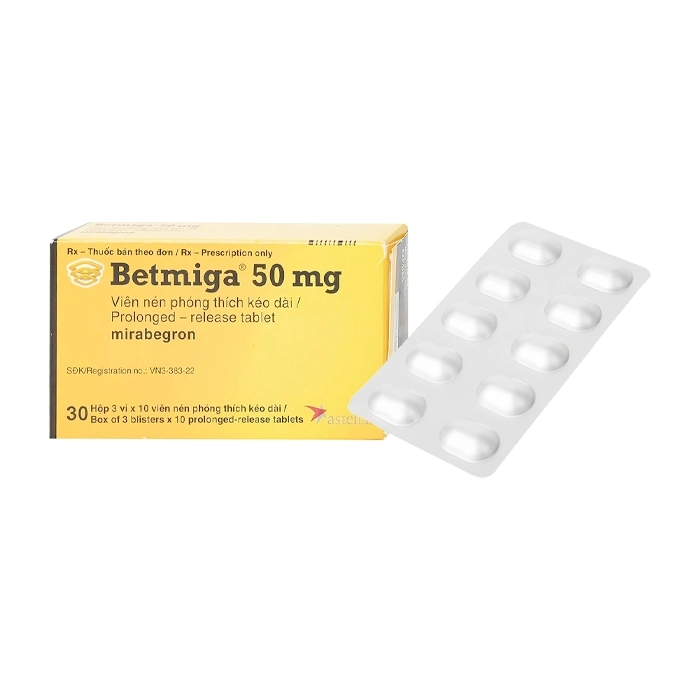
Betmiga 50mg Astellas 3 vỉ x 10 viên
* Hình sản phẩm có thể thay đổi theo thời gian
** Giá sản phẩm có thể thay đổi tuỳ thời điểm
30 ngày trả hàng Xem thêm

Số đăng ký: 001110012025
Cách tra cứu số đăng ký thuốc được cấp phép- Quy cách
- Viên
Tìm thuốc Mirabegron khác
Tìm thuốc cùng thương hiệu Astellas Pharma khác
Thuốc này được bán theo đơn của bác sĩ
Gửi đơn thuốc.svg)
Bạn muốn nhận hàng trước 4h hôm nay. Đặt hàng trong 55p tới và chọn giao hàng 2H ở bước thanh toán. Xem chi tiết
Thông tin sản phẩm
| Số đăng ký: | 001110012025 |
| Hoạt chất: | |
| Quy cách đóng gói: | |
| Thương hiệu: | |
| Xuất xứ: | |
| Thuốc cần kê toa: | |
| Dạng bào chế: | |
| Hàm Lượng: | |
| Nhà sản xuất: |
Nội dung sản phẩm
Thành phần
- Mirabegron: 50mg.
Công dụng (Chỉ định)
- Điều trị triệu chứng tiểu gấp, tiểu nhiều lần và/hoặc tiểu gấp không kiểm soát xảy ra ở bệnh nhân người lớn bị hội chứng bàng quang tăng hoạt.
Liều dùng
Người lớn (kể cả bệnh nhân lớn tuổi):
- Liều khuyến cáo là 50mg một lần mỗi ngày, dùng kèm hoặc không kèm thức ăn.
Những đối tượng đặc biệt:
Suy giảm chức năng gan và thận:
- Betmiga chưa được nghiên cứu ở bệnh nhân bị bệnh thận giai đoạn cuối (GFR <15 mL/phút/1.73 m2 hoặc bệnh nhân chạy thận nhân tạo) hoặc suy giảm chức năng gan nặng (Child-Pugh nhóm C) và do vậy, không được khuyến cáo sử dụng ở những bệnh nhân này.
- Bảng dưới đây liệt kê các khuyến cáo về liều dùng mỗi ngày ở bệnh nhân bị suy giảm chức năng gan hoặc thận có hoặc không dùng phối hợp các thuốc ức chế mạnh CYP3A.

(1) Nhẹ: GFR từ 60 đến 89 mL/phút/1.73 m2; trung bình: GFR từ 30 đến 59 mL/phút/1.73 m2; nặng: GFR từ 15 đến 29 mL/phút/1.73 m2.
(2) Nhẹ: Child-Pugh nhóm A; Trung bình: Child-Pugh nhóm B.
(3) Các thuốc ức chế mạnh CYP3A: Xem phần tương tác thuốc.
Giới tính:
- Không cần chỉnh liều theo giới tính.
Trẻ em:
- Tính an toàn và hiệu quả của Betmiga ở trẻ em dưới 18 tuổi chưa được xác nhận.
- Chưa có số liệu nghiên cứu.
Cách dùng
- Viên nén được dùng một lần mỗi ngày, cùng với chất lỏng, nuốt nguyên viên và không được nhai, chia nhỏ hay nghiền nát.
Quá liều
- Mirabegron được dùng cho người tình nguyện khỏe mạnh ở liều đơn lên đến 400 mg. Ở liều này, các phản ứng phụ được ghi nhận bao gồm đánh trống ngực (1/6 đối tượng) và tăng tần số mạch > 100 lần/phút (3/6 đối tượng). Liều lặp lại mirabegron đến 300 mg mỗi ngày trong 10 ngày cho thấy tăng tần số mạch và huyết áp tâm thu khi dùng cho người tình nguyện khỏe mạnh.
- Điều trị quá liều là điều trị triệu chứng và hỗ trợ. Trong trường hợp quá liều, khuyến cáo nên theo dõi tần số mạch, huyết áp và điện tâm đồ.
Không sử dụng trong trường hợp sau (Chống chỉ định)
- Bệnh nhân quá mẫn với hoạt chất hoặc bất cứ thành phần tá dược nào có trong thuốc.
- Tăng huyết áp không kiểm soát được ở mức độ nghiêm trọng được định nghĩa khi huyết áp tâm thu ≥ 180 mmHg và/hoặc huyết áp tâm trương ≥ 110 mmHg.
Tác dụng không mong muốn (Tác dụng phụ)
Tóm lược tính an toàn:
Tính an toàn của Betmiga được đánh giá trên 8433 bệnh nhân bị bàng quang tăng hoạt, trong đó 5648 bệnh nhân dùng ít nhất một liều mirabegron trong chương trình nghiên cứu lâm sàng giai đoạn 2/3, và 622 bệnh nhân dùng Betmiga ít nhất một năm (365 ngày). Trong ba nghiên cứu mù đôi, đối chứng giả dược, giai đoạn 3, kéo dài 12 tuần, 88% bệnh nhân hoàn tất điều trị với Betmiga, và 4% bệnh nhân ngưng thuốc do các biến cố nguy hại. Hầu hết các phản ứng phụ ở mức độ nhẹ đến trung bình.
Các phản ứng phụ phổ biến nhất được ghi nhận ở bệnh nhân điều trị với Betmiga 50 mg trong ba nghiên cứu mù đôi, đối chứng giả dược, giai đoạn 3, kéo dài 12 tuần là nhịp tim nhanh và nhiễm trùng tiết niệu. Tỷ lệ nhịp tim nhanh là 1.2% bệnh nhân dùng Betmiga 50 mg. Nhịp tim nhanh là nguyên nhân ngưng thuốc ở 0.1% bệnh nhân dùng Betmiga 50 mg. Tỷ lệ nhiễm trùng tiết niệu là 2.9% bệnh nhân dùng Betmiga 50 mg. Không có bệnh nhân nào dùng Betmiga 50 mg phải ngưng thuốc do nhiễm trùng tiết niệu. Các phản ứng phụ nặng gồm có rung nhĩ (0.2%).
Các phản ứng phụ được quan sát thấy trong một nghiên cứu đối chứng (chất đối vận muscarinic) kéo dài 1 năm là tương tự về biểu hiện và độ nặng với các phản ứng phụ được quan sát thấy trong ba nghiên cứu mù đôi, đối chứng giả dược, giai đoạn 3, kéo dài 12 tuần.
Danh mục liệt kê các phản ứng phụ:
Bảng dưới đây trình bày các phản ứng phụ được quan sát thấy khi dùng mirabegron trong ba nghiên cứu mù đôi, đối chứng giả dược, giai đoạn 3, kéo dài 12 tuần.
Tỷ lệ các phản ứng phụ được định nghĩa như sau: rất thường gặp (≥ 1/10); thường gặp (≥ 1/100 đến < 1/10); ít gặp (≥ 1/1.000 đến < 1/100); hiếm gặp (≥ 1/10.000 đến < 1/1.000); rất hiếm gặp (< 1/10.000). Trong mỗi nhóm tỷ lệ, các phản ứng phụ được trình bày theo thứ tự giảm dần về độ nặng.

Quan sát thấy trong giai đoạn hậu mãi:
- Báo cáo các phản ứng phụ đáng ngờ sau khi thuốc được cho phép lưu hành là quan trọng.
- Điều này cho phép theo dõi liên tục cân bằng giữa lợi ích và nguy cơ của thuốc.
- Nhân viên y tế được yêu cầu báo cáo bất kỳ phản ứng phụ đáng ngờ nào.
Tương tác với các thuốc khác
Số liệu thực nghiệm:
- Mirabegron được vận chuyển và chuyển hóa qua nhiều con đường.
- Mirabegron là cơ chất đối với cytochrome P450 (CYP) 3A4, CYP2D6, butyrylcholinesterase, uridine diphospho-glucuronosyltransferases (UGT), P-gp (P-glycoprotein, bơm xuất bào), OCT1 (organic cation transporters, bơm nhập bào), OCT2 và OCT3. Các nghiên cứu về mirabegron sử dụng microsome từ gan người và các men CYP người tái tổ hợp cho thấy mirabegron là chất ức chế CYP2D6 trung bình, lệ thuộc thời gian, và là chất ức chế CYP3A yếu. Mirabegron ức chế vận chuyển thuốc qua trung gian P-gp ở nồng độ cao.
Số liệu trên vật thể sống:
Tính đa hình của CYP2D6:
- Tính đa hình của gen CYP2D6 ảnh hưởng rất ít đến mức tiếp xúc mirabegron trung bình trong huyết tương. Tương tác giữa mirabegron và 1 chất ức chế CYP2D6 được cho là không xảy ra và không được nghiên cứu. Không cần chỉnh liều mirabegron khi dùng phối hợp với các chất ức chế CYP2D6 hoặc ở bệnh nhân chuyển hóa kém CYP2D6.
Tương tác giữa các thuốc:
- Tác động của việc dùng phối hợp nhiều thuốc trên dược động học của mirabegron và tác động của mirabegron trên dược động học của các thuốc khác được khảo sát trong các nghiên cứu đơn và đa liều. Hầu hết các tương tác thuốc được nghiên cứu sử dụng liều 100 mg mirabegron ở dạng viên nén OCAS (oral controlled absorption system, hệ thống hấp thu đường uống được kiểm soát). Các nghiên cứu tương tác giữa mirabegron với metoprolol và với metformin sử dụng mirabegron dạng phóng thích tức thì 160 mg.
- Các tương tác thuốc có ý nghĩa lâm sàng giữa mirabegron và các thuốc ức chế, cảm ứng hoặc là cơ chất đối với một trong các đồng đẳng men CYP hoặc chất vận chuyển được cho là không xảy ra ngoại trừ tác động ức chế của mirabegron trên chuyển hóa của các cơ chất CYP2D6.
Tác động của các chất ức chế men:
- Mức tiếp xúc mirabegron (AUC) tăng 1.8 lần khi có sự hiện khi có sự hiện diện của một chất ức chế mạnh CYP3A/P-gp là ketoconazole ở người tình nguyện khỏe mạnh. Không cần chỉnh liều khi Betmiga được phối hợp với các chất ức chế CYP3A và hoặc P-gp. Tuy nhiên, ở bệnh nhân bị suy giảm chức năng thận nhẹ đến trung bình (GFR 30 đến 89 mL/phút/1.73 m2) hoặc suy giảm chức năng gan nhẹ (Child-Pugh nhóm A) đang dùng đồng thời các chất ức chế mạnh CYP3A, chẳng hạn như itraconazole, ketoconazole, ritonavir và clarithromycin, liều khuyến cáo là 25 mg một lần mỗi ngày, kèm hoặc không kèm thức ăn. Betmiga chưa được khuyến cáo ở bệnh nhân bị suy giảm chức năng thận nặng (GFR 15 đến 29 mL/phút/1.73 m2) hoặc bệnh nhân bị suy giảm chức năng gan trung bình (Child-Pugh nhóm B) đang dùng đồng thời các chất ức chế mạnh CYP3A.
Tác động của các chất cảm ứng men:
- Các chất cảm ứng CYP3A hoặc P-gp làm giảm nồng độ mirabegron trong huyết tương. Không cần chỉnh liều mirabegron khi dùng chung với rifampicin hoặc các chất cảm ứng CYP3A hoặc P-gp khác ở liều điều trị.
Tác động của mirabegron trên các cơ chất CYP2D6:
- Ở người tình nguyện khỏe mạnh, khả năng ức chế của mirabegron đối với CYP2D6 là trung bình và hoạt tính CYP2D6 hồi phục trong vòng 15 ngày sau khi ngưng mirabegron. Dùng liều lặp lại một lần mỗi ngày mirabegron dạng phóng thích tức thì làm tăng Cmax và AUC của metoprolol liều đơn lên 90% và 229%, tương ứng. Dùng liều lặp lại một lần mỗi ngày mirabegron làm tăng Cmax và AUC của desipramine liều đơn lên 79% và 241%, tương ứng.
- Nên thận trọng nếu mirabegron được dùng phối hợp với các thuốc có chỉ số điều trị hẹp và được chuyển hóa đáng kể nhờ CYP2D6, chẳng hạn như thioridazine, các thuốc chống loạn nhịp nhóm 1C (chẳng hạn như flecainide, propafenone) và thuốc chống trầm cảm ba vòng (chẳng hạn như imipramine, desipramine). Cũng cần thận trọng nếu mirabegron được dùng phối hợp với các cơ chất CYP2D6 mà liều cần được cá thể hóa.
Tác động của mirabegron trên các chất vận chuyển:
- Mirabegron là chất ức chế yếu P-gp. Mirabegron làm tăng Cmax và AUC của digoxin, là cơ chất đối với P-gp, lên 29% và 27%, tương ứng, ở người tình nguyện khỏe mạnh. Ở bệnh nhân dùng phối hợp Betmiga và digoxin, khởi đầu nên kê toa digoxin ở liều thấp nhất. Nồng độ digoxin huyết thanh cần được theo dõi để chỉnh liều digoxin nhằm đạt được tác dụng lâm sàng mong muốn. Khả năng ức chế P-gp của mirabegron cần được xem xét khi Betmiga được phối hợp với các cơ chất P-gp nhạy cảm, chẳng hạn như dabigatran.
Các tương tác khác:
- Không có tương tác có ý nghĩa lâm sàng nào được quan sát thấy khi mirabegron được dùng chung với solifenacin, tamsulosin, warfarin và metformin ở liều điều trị hoặc với thuốc ngừa thai uống kết hợp chứa ethinylestradiol và levonorgestrel. Không khuyến cáo chỉnh liều.
- Tăng mức tiếp xúc mirabegron do tương tác thuốc có thể đi kèm với tăng tần số mạch.
Lưu ý khi sử dụng (Cảnh báo và thận trọng)
Suy giảm chức năng thận:
- Betmiga chưa được nghiên cứu ở bệnh nhân bị bệnh thận giai đoạn cuối (GFR < 15 mL/phút/1.73 m2 hoặc bệnh nhân chạy thận nhân tạo) và do vậy, chưa được khuyến cáo sử dụng ở những bệnh nhân này. Các số liệu nghiên cứu ở bệnh nhân bị suy giảm chức năng thận nặng (GFR 15 đến 29 mL/phút /1.73 m2) còn ít; dựa trên một nghiên cứu dược động học, giảm liều còn 25 mg được khuyến cáo ở những bệnh nhân này. Betmiga chưa được khuyến cáo sử dụng ở bệnh nhân bị suy giảm chức năng thận nặng (GFR 15 đến 29 mL/phút/1.73 m2) đang dùng phối hợp các thuốc ức chế mạnh CYP3A.
Suy giảm chức năng gan:
- Betmiga chưa được nghiên cứu ở bệnh nhân bị suy giảm chức năng gan nặng (Child-Pugh nhóm C) và do vậy, chưa được khuyến cáo sử dụng ở những bệnh nhẫn này. Betmiga chưa được khuyến cáo sử dụng ở bệnh nhân bị suy giảm chức năng gan trung bình (Child-Pugh nhóm B) đang dùng phối hợp các thuốc ức chế mạnh CYP3A.
Tăng huyết áp:
- Betmigacó thể làm tăng huyết áp. Khuyến cáo nên đo huyết áp định kỳ, đặc biệt ở các bệnh nhân tăng huyết áp.
- Không khuyến cáo dùng Betmiga trên bệnh nhân tăng huyết áp nặng chưa được khống chế, được định nghĩa là huyết áp tâm thu ≥ 180 mmHg và/hoặc huyết áp tâm trương ≥ 110 mmHg.
Bệnh nhân bị chứng kéo dài QT bẩm sinh hoặc mắc phải:
- Betmiga ở liều điều trị, không làm kéo dài QT có ý nghĩa lâm sàng trong các nghiên cứu lâm sàng. Tuy nhiên, vì các bệnh nhân với bệnh sử rõ ràng kéo dài QT hoặc các bệnh nhân đang dùng các thuốc được biết kéo dài khoảng QT không được đưa vào các nghiên cứu này, tác động của mirabegron trên những bệnh nhân này chưa được biết. Cần thận trọng khi dùng mirabegron ở những bệnh nhân này.
- Bệnh nhân bị tắc nghẽn đường tiết niệu dưới và bệnh nhân dùng các thuốc kháng muscarinic vì bàng quang tăng hoạt
- Bí tiểu ở bệnh nhân bị tắc nghẽn đường tiết niệu dưới và bệnh nhân dùng các thuốc kháng muscarinic để điều trị bàng quang tăng hoạt đã được ghi nhận trong các báo cáo hậu mãi ở bệnh nhân dùng mirabegron.
- Nghiên cứu đối chứng lâm sàng về tính an toàn ở bệnh nhân bị tắc nghẽn đường tiết niệu dưới không thấy tăng nguy cơ bí tiểu ở bệnh nhân điều trị với Betmiga; tuy nhiên, Betmiga nên dùng thận trọng ở bệnh nhân bị tắc nghẽn đường tiết niệu dưới có ý nghĩa lâm sàng.
- Betmiga cũng nên dùng thận trọng ở bệnh nhân đang dùng các thuốc kháng muscarinic để điều trị bàng quang tăng hoạt.
Phụ nữ mang thai và cho con bú
Phụ nữ mang thai:
- Không có nhiều số liệu nghiên cứu về sử dụng Betmiga ở phụ nữ mang thai. Các nghiên cứu ở động vật cho thấy độc tính sinh sản.
- Betmiga chưa được khuyến cáo trong thời gian mang thai và ở phụ nữ có thể mang thai không sử dụng thuốc ngừa thai.
Phụ nữ cho con bú:
- Mirabegron được bài xuất trong sữa động vật gặm nhấm, và do đó, được tiên đoán sẽ hiện diện trong sữa người. Chưa có nghiên cứu nào được thực hiện để đánh giá tác động của mirabegron trên sản xuất sữa ở người, sự hiện diện của mirabegron trong sữa người, hoặc tác động của mirabegron trên trẻ được cho bú sữa mẹ. Betmiga không nên dùng trong giai đoạn cho con bú.
Người lái xe và vận hành máy móc
- Betmiga không ảnh hưởng hoặc ảnh hưởng không đáng kể đến khả năng lái xe và vận hành máy móc.
Bảo quản
- Nơi khô, tránh ánh sáng, nhiệt độ dưới 30°C.
Đánh Giá - Bình Luận
- Đặt đơn thuốc trong 30 phút. Gửi đơn
- Giao nhanh 2H nội thành HCM Chính sách giao hàng 2H.
- Mua 1 tặng 1 Đông Trùng Hạ Thảo Famitaa. Xem ngay
- Mua Combo giá tốt hơn. Ghé ngay
- Miễn phí giao hàng cho đơn hàng 700K
- Đổi trả trong 6 ngày. Chính sách đổi trả
- CSKH:
0818006928